¿Qué es la contaminación del aire?
La polución del aire también provoca daños en el medio ambiente, habiendo afectado la flora arbórea, la fauna y los lagos. La contaminación también ha reducido el espesor de la capa de ozono. Además, produce el deterioro de edificios, monumentos, estatuas y otras estructuras.
La contaminación del aire también es causante de neblina, la cual reduce la visibilidad en los parques nacionales y otros lugares y, en ocasiones, constituye un obstáculo para la aviación.
¿Cuáles son los principales contaminantes del aire?
Monóxido de Carbono (CO): Es un gas inodoro e incoloro. Cuando se lo inhala, sus moléculas ingresan al torrente sanguíneo, donde inhiben la distribución del oxígeno. En bajas concentraciones produce mareos, jaqueca y fatiga, mientras que en concentraciones mayores puede ser fatal.
El monóxido de carbono se produce como consecuencia de la combustión incompleta de combustibles a base de carbono, tales como la gasolina, el petróleo y la leña, y de la de productos naturales y sintéticos, como por ejemplo el humo de cigarrillos. Se lo halla en altas concentraciones en lugares cerrados, como por ejemplo garajes y túneles con mal ventilados, e incluso en caminos de tránsito congestionado.
Dióxido de Carbono (CO2): Es el principal gas causante del efecto invernadero. Se origina a partir de la combustión de carbón, petróleo y gas natural. En estado líquido o sólido produce quemaduras, congelación de tejidos y ceguera. La inhalación es tóxica si se encuentra en altas concentraciones, pudiendo causar incremento del ritmo respiratorio, desvanecimiento e incluso la muerte.
Clorofluorcarbonos (CFC): Son substancias químicas que se utilizan en gran cantidad en la industria, en sistemas de refrigeración y aire acondicionado y en la elaboración de bienes de consumo. Cuando son liberados a la atmósfera, ascienden hasta la estratosfera. Una vez allí, los CFC producen reacciones químicas que dan lugar a la reducción de la capa de ozono que protege la superficie de la Tierra de los rayos solares. La reducción de las emisiones de CFC y la suspensión de la producción de productos químicos que destruyen la capa de ozono constituyen pasos fundamentales para la preservación de la estratosfera.
Contaminantes atmosféricos peligrosos (HAP): Son compuestos químicos que afectan la salud y el medio ambiente. Las emanaciones masivas –como el desastre que tuvo lugar en una fábrica de agroquímicos en Bhopal, India– pueden causar cáncer, malformaciones congénitas, trastornos del sistema nervioso y hasta la muerte
Las emisiones de HAP provienen de fuentes tales como fábricas de productos químicos, productos para limpieza en seco, imprentas y vehículos (automóviles, camiones, autobuses y aviones).
Plomo: Es un metal de alta toxicidad que ocasiona una diversidad de trastornos, especialmente en niños pequeños. Puede afectar el sistema nervioso y causar problemas digestivos. Ciertos productos químicos que contienen plomo son cancerígenos. El plomo también ocasiona daños a la fauna y flora silvestres.
El contenido de plomo de la gasolina se ha ido eliminando gradualmente, lo que ha reducido considerablemente la contaminación del aire. Sin embargo, la inhalación e ingestión de plomo puede tener lugar a partir de otras fuentes, tales como la pintura para paredes y automóviles, los procesos de fundición, la fabricación de baterías de plomo, los señuelos de pesca, ciertas partes de las balas, algunos artículos de cerámica, las persianas venecianas, las cañerías de agua y algunas tinturas para el cabello.
Ozono (O3): Este gas es una variedad de oxígeno, que, a diferencia de éste, contiene tres átomos de oxígeno en lugar de dos. El ozono de las capas superiores de la atmósfera, donde se forma de manera espontánea, constituye la llamada “capa de ozono”, la cual protege la tierra de la acción de los rayos ultravioletas. Sin embargo, a nivel del suelo, el ozono es un contaminante de alta toxicidad que afecta la salud, el medio ambiente, los cultivos y una amplia diversidad de materiales naturales y sintéticos. El ozono produce irritación del tracto respiratorio, dolor en el pecho, tos persistente, incapacidad de respirar profundamente y un aumento de la propensión a contraer infecciones pulmonares. A nivel de medio ambiente, es perjudicial para los árboles y reduce la visibilidad.
El ozono que se halla a nivel del suelo proviene de la descomposición (oxidación) de los compuestos orgánicos volátiles de los solventes, de las reacciones entre substancias químicas resultantes de la combustión del carbón, gasolina y otros combustibles y de las substancias componentes de las pinturas y spray para el cabello. La oxidación se produce rápidamente a alta temperatura ambiente. Los vehículos y la industria constituyen las principales fuentes del ozono a nivel del suelo.
Oxido de nitrógeno (NOx): Proviene de la combustión de la gasolina, el carbón y otros combustibles. Es uno de los principales causas del smog y la lluvia ácida. El primero se produce por la reacción de los óxidos de nitrógeno con compuestos orgánicos volátiles. En altas concentraciones, el smog puede producir dificultades respiratorias en las personas asmáticas, accesos de tos en los niños y trastornos en general del sistema respiratorio. La lluvia ácida afecta la vegetación y altera la composición química del agua de los lagos y ríos, haciéndola potencialmente inhabitable para las bacterias, excepto para aquellas que tienen tolerancia a los ácidos.
Partículas: En esta categoría se incluye todo tipo de materia sólida en suspensión en forma de humo, polvo y vapores. Además, de reducir la visibilidad y la cubierta del suelo, la inhalación de estas partículas microscópicas, que se alojan en el tejido pulmonar, es causante de diversas enfermedades respiratorias. Las partículas en suspensión también son las principales causantes de la neblina, la cual reduce la visibilidad.
Las partículas de la atmósfera provienen de diversos orígenes, entre los cuales podemos mencionar la combustión de diesel en camiones y autobuses, los combustibles fósiles, la mezcla y aplicación de fertilizantes y agroquímicos, la construcción de caminos, la fabricación de acero, la actividad minera, la quema de rastrojos y malezas y las chimeneas de hogar y estufas a leña.
Dióxido de azufre (SO2): Es un gas inodoro cuando se halla en bajas concentraciones, pero en alta concentración despide un olor muy fuerte. Se produce por la combustión de carbón, especialmente en usinas térmicas. También proviene de ciertos procesos industriales, tales como la fabricación de papel y la fundición de metales. Al igual que los óxidos de nitrógeno, el dióxido de azufre es uno de los principales causantes del smog y la lluvia ácida. Está estrechamente relacionado con el ácido sulfúrico, que es un ácido fuerte. Puede causar daños en la vegetación y en los metales y ocasionar trastornos pulmonares permanentes y problemas respiratorios
Compuestos orgánicos volátiles (VOC): Son substancias químicas orgánicas. Todos los compuestos orgánicos contienen carbono y constituyen los componentes básicos de la materia viviente y de todo derivado de la misma. Muchos de los compuestos orgánicos que utilizamos no se hallan en la naturaleza, sino que se obtienen sintéticamente. Los compuestos químicos volátiles emiten vapores con gran facilidad. La emanación de vapores de compuestos líquidos se produce rápidamente a temperatura ambiente.
Los VOC incluyen la gasolina, compuestos industriales como el benceno, solventes como el tolueno, xileno y percloroetileno (el solvente que más se utiliza para la limpieza en seco). Los VOC emanan de la combustión de gasolina, leña, carbón y gas natural, y de solventes, pinturas, colas y otros productos que se utilizan en el hogar o en la industria. Las emanaciones de los vehículos constituyen una importante fuente de VOC. Muchos compuestos orgánicos volátiles son peligrosos contaminantes del aire. Por ejemplo, el benceno tiene efectos cancerígenos.
¿Qué puedo hacer para disminuir mi aporte a la contaminación del aire?
Hay muchas formas de ayudar a reducir la contaminación del aire. Se puede hacer un aporte significativo a la purificación del aire simplemente siguiendo (o no, según sea el caso) ciertas prácticas sencillas
Dado que los vehículos contribuyen enormemente a la polución del aire mediante la emisión de CO2, NOx, ozono, VOC, HAP, CFC y partículas volátiles, la modificación de los hábitos de conducción contribuirá a reducir la misma.
Reducir el uso del automóvil, usar medios de transporte público o bicicleta, caminar más, utilizar el automóvil como medio de transporte colectivo, etc. constituyen la mejor manera de ayudar a reducir la polución atmosférica.
Si conduce, tenga en cuenta lo siguiente:
· Evite circular a alta velocidad
· Cuando compre un vehículo, elija uno que tenga alto rendimiento en millas por litro de gasolina.
· No sobrellene el tanque de gasolina
· No cargue gasolina en días de alto contenido de ozono. Trate de hacerlo después de que oscurezca.
· Use un modelo de vehículo que sea lo más nuevo posible, ya que los modelos nuevos son, en general, menos contaminantes.
· Utilice un vehículo alternativo, como por ejemplo el automóvil eléctrico, o uno que funcione con otro tipo de combustible.
· Conduzca suavemente y evite que su automóvil permanezca sin uso durante mucho tiempo.
· Si su automóvil es de un modelo anterior a 1995, haga cambiar el peligroso sistema de aire acondicionado R-12 (clorofluocarbonado) por el R-134-a, que es más seguro, con lo cual contribuirá a reducir el agujero de ozono.
· Mantenga su automóvil en buen estado, poniendo especial atención en el sistema de escape.
· Asegúrese de que los neumáticos tengan la presión de aire adecuada.
· Mantenga en buen estado el sistema de aire acondicionado de su vehículo, asegurándose de que no haya filtraciones.
· Haga menor cantidad de viajes. Planifique su itinerario, de manera de evitar las zonas de tránsito congestionado.
· Reduzca el uso de gasolina tanto como le sea posible –la forma y el diseño del automóvil pueden ser factores determinantes del consumo.
He aquí otras prácticas mediante las cuales Ud. puede contribuir a disminuir la contaminación del aire:
· Posponga las tareas de jardinería que requieran el uso de herramientas a gasolina en días de alto nivel de de ozono.
· Consuma alimentos orgánicos o al menos aquellos no hayan sido sometidos a un uso tan intensivo de agroquímicos.
· Restrinja la limpieza en seco.
· Evite el uso de pinturas, aceites y solventes en días de alta concentración de ozono.
· Reduzca el consumo de electricidad, lo cual contribuirá a disminuir las emanaciones de SO2, NOx, VOC y partículas.
· Prenda el carbón de leña con un encendedor eléctrico en vez de hacerlo con combustible líquido.
· Restrinja-reutilice-recicle. Un menor consumo redundará en menor contaminación atmosférica de todo tipo.
El ácido sulfúrico, principal contaminante del aire en nuestro país: RETC
Uno de los principales contaminantes del aire que emite la industria es el ácido sulfúrico, del cual en un año se emitieron 241 mil toneladas, mientras que 62 toneladas de plomo se fueron al suelo, según los primeros resultados del Registro de Emisiones y Transferencia de Contaminantes (RETC) que se aplica en 17 países; México es el primero en vías de desarrollo que lo utiliza.
En el periodo de un año se emitieron al aire 250 mil toneladas de sustancias; al agua, tres mil 500 toneladas; al suelo, más de 102 toneladas, mientras que se emiten mil 390 millones de toneladas de gases de efecto invernadero.
El presidente del Instituto Nacional de Ecología (INE), Adrián Fernández, informó ayer, durante la presentación del informe final del RETC correspondiente a 2004, que se evalúan 104 sustancias, la mayoría de ellas corresponde a componentes orgánicos persistentes, metales pesados, sustancias agotadoras de la capa de ozono y gases con efecto invernadero. Este reporte comenzó a ser obligatorio para la industria a partir de 2005 y lo más importante es que la gente podrá conocer qué contaminantes genera la in
www.jornada.unam.mx/2006/11/28/index.php?section=sociedaddustria que tiene a su lado y cuánto generan, agregó.












 DESTILACION:es el metodo por el cual se separa una mezcla de dos o mas liuquidos misibles .deben detener por lo menos 5 ° de ebullicion .este metodo se emplea ya sea para purificar un liquido o separarlo.
DESTILACION:es el metodo por el cual se separa una mezcla de dos o mas liuquidos misibles .deben detener por lo menos 5 ° de ebullicion .este metodo se emplea ya sea para purificar un liquido o separarlo.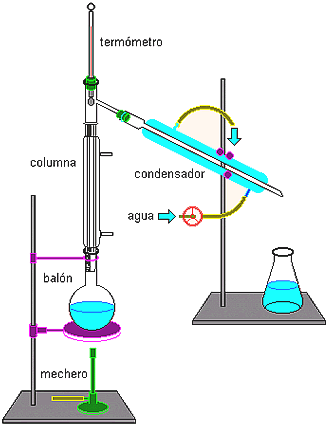 CROMATOLOGIA:esto consiste en la separacion de aquellos componentes que conforman a una mezcla homogenea .se utiliza mucho en bioquimica ,una de la manera que se puede realizar en un papel filtro no necesariamente de ese material se coloca una manchaen el papel , puede ser de plumin, se va acolocar en un recipiente con agua ,que no toque la mancha y poco a poco veremos como se va corriendo la mancha asi separandose sus componentes.
CROMATOLOGIA:esto consiste en la separacion de aquellos componentes que conforman a una mezcla homogenea .se utiliza mucho en bioquimica ,una de la manera que se puede realizar en un papel filtro no necesariamente de ese material se coloca una manchaen el papel , puede ser de plumin, se va acolocar en un recipiente con agua ,que no toque la mancha y poco a poco veremos como se va corriendo la mancha asi separandose sus componentes.















